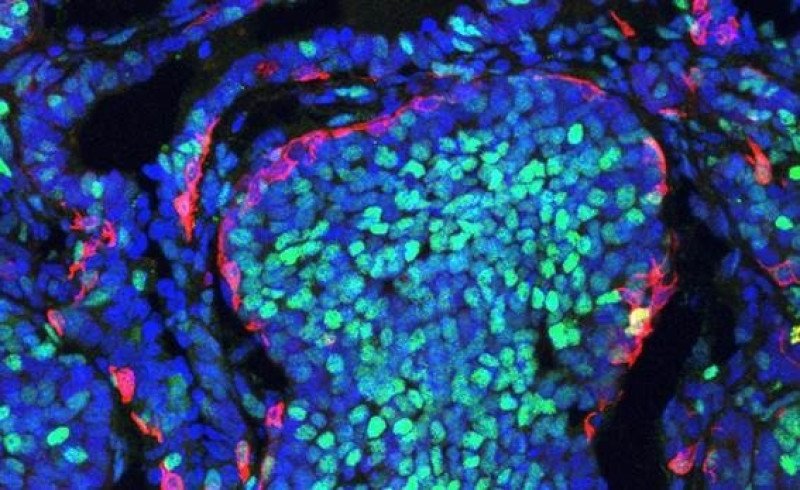
Un estudio liderado por el laboratorio de Plasticidad Celular en Desarrollo y Enfermedad, que dirige Ángela Nieto en el Instituto de Neurociencias (IN-CSIC-UMH), centro mixto del Consejo Superior de Investigaciones Científicas (CSIC) y la Universidad Miguel Hernández (UMH) de Elche, muestra que dentro de cada tumor hay grupos de células que reciben instrucciones para expandirse por el organismo de forma maligna y otros grupos de células que se encargan de combatir el daño que supone el tumor canceroso.
El laboratorio que lidera Nieto en el IN-CSIC-UMH ha estudiado a lo largo de 20 años un proceso llamado transición epitelio-mesénquima (EMT, por sus siglas en inglés), que durante el desarrollo embrionario permite la migración de células hacia distintos destinos para formar órganos y tejidos. Este mismo proceso lo utiliza el cáncer para diseminar sus células y dar lugar a las metástasis, tumores en órganos distintos al originario que causan más del 90% de las muertes asociadas a esta enfermedad.
El profundo conocimiento que el equipo de Nieto ha desarrollado sobre este proceso les llevó a descubrir también que, en adultos, es un mecanismo de defensa que utilizan las células para protegerse cuando detectan un tejido dañado y repararlo. Sin embargo, cuando el daño es crónico, las células ya no son capaces de reparar; segregan colágeno que se va acumulando, y se desarrolla una fibrosis que acaba degenerando el órgano.
Ahora, en este trabajo recientemente publicado en la revista ‘Nature Cancer’, los investigadores han demostrado que en el cáncer se activan de forma inesperada, tanto el programa del desarrollo embrionario como el del adulto. «Los dos programas se activan en el tumor, pero en poblaciones diferentes. Es decir, observamos programas opuestos pro y antitumorales que están funcionando a la vez», explica la científica del CSIC.
En esta línea, el investigador Khalil Kass Youssef, primer autor del artículo, destaca que una misma célula puede responder de una manera o de otra. «Cuando la transición epitelio mesénquima se activa con los dos programas en células distintas, se produce una heterogeneidad intratumoral que, hasta ahora, era totalmente desconocida», señala.
Además, los investigadores han observado que las dos poblaciones celulares tienen ubicaciones muy diferenciadas dentro del tumor. Las células que activan el proceso EMT propio del desarrollo embrionario se encuentran en la periferia del tumor, mientras que las células que activan el proceso de reparación se concentran en el centro del tumor.
Un factor clave en la desdiferenciación celular Cuando las células se diferencian durante el desarrollo de un individuo reciben una serie de instrucciones de identidad celular, que determinan las funciones que llevarán a cabo a lo largo de su vida. Los resultados de este nuevo trabajo ponen de manifiesto que la EMT es un mecanismo de plasticidad celular que permite que las células adultas se desdiferencien para que puedan actuar de otra manera.
«Si la célula está muy diferenciada, no puede hacer nada más que lo que ya sabe hacer. Entonces cuando debe responder a un estímulo como, por ejemplo, el daño, tiene que revertir un poco esas instrucciones para poder hacer otras funciones», explica Nieto, que destaca que este mecanismo de plasticidad es esencial para llevar a cabo procesos regenerativos.
Los resultados de este estudio apuntan a que el factor de transcripción Snail1 juega un papel clave en ese proceso, ya que aparece en primer lugar y en ambas trayectorias EMT. Por otro lado, los investigadores han comprobado que el factor de transcripción Prrx1 es determinante para la trayectoria de diseminación, ya que cuando eliminan este gen, la capacidad metastásica del tumor desaparece.
Los expertos observaron que bloquear la trayectoria EMT de diseminación no sólo reduce la metástasis, sino que además conlleva que más células se incorporan a la trayectoria EMT inflamatoria y favorece la captación de un tipo de macrófagos que se encarga de combatir a las células cancerosas.
«Hemos confirmado que ambas trayectorias EMT son interdependientes. Se trata de un hallazgo muy valioso que abre oportunidades al diseño de nuevas estrategias terapéuticas para tratar tipos de cáncer agresivos que son altamente metastásicos y muy resistentes a las terapias actuales», hace hincapié hincapié en la trascendencia de estos el investigador Youssef.
HAN DESARROLLADO TRES MODELOS DE RATONES
Los investigadores han desarrollado este estudio empleando tres modelos de ratones: un modelo embrionario para estudiar el desarrollo de la cresta neural en los embriones, un modelo adulto de fibrosis renal y, por último, un modelo de cáncer de mama. A través de técnicas de análisis de célula única (single-cell sequencing) y de análisis de datos computacionales, para los que Nitin Narwade, científico computacional del grupo que dirige Nieto, ha colaborado con el investigador José López-Atalaya, que dirige el laboratorio de Plasticidad Celular y Neuropatología en el IN-CSIC-UHM, los expertos pudieron definir todos los estados celulares pro y antitumorales.
Conocer en detalle cómo evolucionan los tumores para hacerse malignos es el objetivo del estudio. Mediante el uso de ‘machine learning’, los científicos realizaron predicciones para determinar la evolución de las células cancerosas que luego validaron con estudios experimentales en modelos animales.
Además, con Aida Arcas, también del laboratorio de Nieto, y la catedrática Gema Moreno Bueno, del Instituto de Investigaciones Biomédicas Sols-Morreale (IIBM-CSIC-UAM) y de la Fundación MD Anderson (ambos en Madrid), han mostrado que los datos de los modelos animales se correlacionan con datos de pacientes. «Hemos confirmado que todos los estados celulares de las dos trayectorias descubiertas en los modelos animales se pueden identificar en los tumores humanos, particularmente en el tumor de mama triple negativo, que es el que tiene peor pronóstico», explica Moreno Bueno.
Este trabajo ha sido posible gracias a la financiación del Ministerio de Ciencia, Innovación y Universidades, la Fundación Científica de la Asociación Española Contra el Cáncer (AECC), el Instituto de Salud Carlos III, el Programa PROMETEO de la Generalitat Valenciana, el Consejo Europeo de Investigación (ERC), la Agencia Estatal de Investigación, a través de la «Programa Severo Ochoa» para Centros de Excelencia en I+D, la Organización Europea de Biología Molecular (EMBO) y el Programa de Investigación e Innovación Horizonte 2020 de la Unión Europea NEUcrest en el marco de las acciones Marie Sklodowska-Curie.